2.
Серологические методы диагностики лейкоза крупного рогатого
скота
2.1. Реакция
иммунодиффузии (РИД).
2.1.1. Сущность
метода.Метод основан на
обнаружении в сыворотке крови животных специфических
преципитирующих антител к антигенам вируса лейкоза крупного
рогатого скота. Специфические антитела появляются в крови через 2-8
недель после заражения животного ВЛКРС и сохраняются в организме
пожизненно.
https://www.youtube.com/watch{q}v=upload
2.1.2. Серологическому
исследованию на лейкоз подвергают животных в возрасте 6 месяцев и
старше. Пробы крови для исследований берут не ранее чем через 30
суток после введения животным вакцин и аллергенов, у стельных
животных – за 30 суток до отела или через 30 суток после него.
2.1.3. Получение
сыворотки. Сыворотки для исследования получают из крови испытуемого
животного в количестве 2-3 мл и направляют в лабораторию с
сопроводительным документом, в котором указывают название
хозяйства, номер (кличку), возраст, пол, породу животного.Кровь (для получения
сыворотки) берут в бактериологические пробирки, выдерживают 1-2 ч в
теплом месте (не выше 40°С).
Для лучшего отделения сыворотки
образовавшийся сгусток обводят в пробирке профломбированной после
каждой пробы стальной спицей (проволокой). После этого пробирки
выдерживают в течение 20-24 ч при 4-10°С. Полученные пробы
сыворотки сливают в пробирки Флоринского (достаточно 2-3 мл) и
маркируют.
–
стандартный штамп-пробойник для просечения лунок в агаре;-
пипетки пастеровские или автоматические со сменными
наконечниками;-
рН-метр;-
осветитель;-
хлорид натрия (х.ч.);-
дистиллированная вода.
2.1.5. Постановка
РИД.Подготовку компонентов
реакции к работе осуществляют в соответствии с “Наставлением по
применению набора для серологической диагностики лейкоза крупного
рогатого скота”. Антиген растворяют в 5 см разбавителя. Растворенный антиген хранят
при температуре 4°С не более двух недель.
Разбавитель ССА и солевую
смесь агара переносят в колбу и приливают дистиллированную воду до
объема 200 см, затем колбу помещают в водяную баню и
выдерживают до полного расплавления гранул агара. Расплавленный
агаровый гель, имеющий температуру 50-70°С, разливают слоем 2-3 мм
(12-15 мл) в обезжиренные чашки Петри и оставляют их приоткрытыми
при комнатной температуре в течение 1 ч.
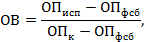
После застывания агара
специальным штампом-пробойником делают лунки в геле, не допуская
образования трещин между ними и отслоения агара от дна чашки. В
каждой чашке делают по четыре фигуры, каждая из которых состоит из
семи лунок: одна в центре, остальные по периферии. Диаметр каждой
лунки составляет 7 мм, расстояние между центральной и
периферическими лунками – 3 мм.
Образовавшиеся диски геля удаляют
из лунок канюлей, соединенных с вакуумным насосом.Антиген, контрольные и
испытуемые сыворотки вносят в лунки каждой фигуры пастеровскими или
автоматическими пипетками со сменными наконечниками.Антиген (А) вносят в
центральную лунку, две диаметрально противоположные лунки заполняют
контрольной сывороткой (КС).
2.1.6. Учет и оценка
результатов реакции.
2.1.6.1. Реакцию
учитывают не ранее чем через 48 ч и не позднее чем через 96 ч.
Чашки просматривают на темном фоне, направляя сфокусированный луч
осветителя на дно чашки под углом 30-45°. Специфичность реакции
оценивают по контрольной линии преципитата. Если она отсутствует
или слабо выражена, то реакцию следует повторить.
Специфическая линия
преципитации, формируемая преципитирующей контрольной сывороткой и
антигеном, должна быть четкой, иметь форму прямой, располагаться на
одинаковом расстоянии от лунок с антигеном и контрольной
сывороткой.Неспецифической считают
линию преципитации, которая образуется между лунками с испытуемой
сывороткой и антигеном, но не сливается с контрольной линией
преципитации, а пересекает ее или упирается в нее, образуя
угол.
2.1.6.2. Оценка
результатов.В
зависимости от наличия специфических антител против антигенов ВЛКРС
в испытуемой сыворотке реакцию оценивают как положительную или
отрицательную.Положительной считают
реакцию, если между лунками с антигеном и испытуемой сывороткой
образуется полоса преципитации, которая соединяется с полосой
преципитации контрольной сыворотки, образуя непрерывную линию, то
есть идентична ей (рис.
1 – не приводится, поз.1):-
если линия преципитации между лунками с испытуемой сывороткой и
антигеном отсутствует, но контрольная линия преципитирующей
сыворотки образует вблизи лунки с испытуемой линией изгиб,
направленный в сторону лунки с антигеном (рис.1, поз.2), –
слабоположительная сыворотка;
–
если контрольная линия значительно укорочена со стороны лунки с
испытуемой сывороткой и имеет размытый изгиб к лунке с антигеном
или образует линию преципитации, расположенную очень близко от
лунки с антигеном (рис.1, поз.2), – резко положительная
сыворотка.Положительно реагирующая
сыворотка может образовывать вторую линию преципитации, которая
располагается ближе к лунке с испытуемой сывороткой.
Эта линия
указывает на наличие в сыворотке преципитирующих антител против
второго антигена (р-24) ВЛКРС (рис.1, поз.3).При образовании толстой,
короткой, без загибов контрольной линии преципитации, не доходящей
до лунки с испытуемой сывороткой, необходимо провести раститровку
этой испытуемой сыворотки физраствором до получения результата,
который можно будет оценить как отрицательный, положительный или
неспецифический.

Для этого необходимо физиологический раствор в
объеме 100-500 мкл разлить в пробирки или в лунки стандартных
пластиковых плат для постановки серологических реакций (количество
пробирок или лунок соответствует числу необходимых разведений). В
первую пробирку или лунку с физраствором внести такой же объем
сыворотки, тщательно перемешать и перенести той же пипеткой в том
же объеме в следующую пробирку или лунку, затем после перемешивания
– в следующую и т.д.
https://www.youtube.com/watch{q}v=ytadvertise
В результате в первой пробирке или лунке
испытуемая сыворотка разведена в 2 раза, во второй – в 4 раза, в
третьей – в 8 раз и т.д.Реакцию считают
отрицательной, если контрольная линия продолжается до лунки с
испытуемой сывороткой без загиба (рис.1, поз.4).В
случаях, когда линия преципитации плохо просматривается или имеется
зона опалесценции вокруг лунок, реакцию следует переставить.
2.1.7. Животных,
сыворотки крови которых дали положительный результат в РИД,
признают зараженными вирусом лейкоза, и их необходимо исследовать
гематологическим методом.
2.2. Метод
иммуноферментного анализа (ИФА).
2.2.1. Сущность метода.
Иммуноферментный анализ основан на иммунохимической реакции
взаимодействия антиген-антитело и использовании в качестве
индикатора этой реакции маркированных ферментами антител или
антигенов.Существует две
модификации иммуноферментного анализа: непрямой и конкурентный.Метод непрямого
иммуноферментного анализа основан на связывании специфических к
вирусу лейкоза антител с антигеном ВЛКРС, адсорбированным на
стенках лунок планшета для микротитрования.
Связавшиеся антитела
выявляют с помощью видоспецифических антител, меченых ферментом
(пероксидазой), с последующим ферментативным превращением
бесцветного субстрата пероксидазой в окрашенный продукт.
Интенсивность окраски прямо пропорциональна содержанию антител к
ВЛКРС в сыворотке крови.В
основе конкурентного иммуноферментного анализа лежит способность
антител к ВЛКРС, содержащихся в испытуемой сыворотке, блокировать
связывание антигена ВЛКРС с антителами к ВЛКРС, иммобилизованными
(адсорбированными) на стенках лунок планшетов для микротитрования
(МТП).
Антиген ВЛКРС, связавшийся с иммобилизованными антителами,
выявляют с помощью антител к ВЛКРС, меченных пероксидазой
(конъюгатом антител с пероксидазой) и последующего ферментативного
превращения бесцветного субстрата пероксидазы в окрашенный продукт.
В том случае, если испытуемый материал не содержал антител к ВЛКРС,
интенсивность окрашивания максимальна. Антитела к ВЛКРС в
испытуемом материале снижают интенсивность окрашивания прямо
пропорционально их содержанию.
2.2.2. Материалы и
оборудование.
2.2.2.1. Материалом для
исследования методом иммуноферментного анализа может служить
сыворотка крови, секрет вымени сухостойных коров, молозиво и
молоко.При исследовании
сывороток крови их получают, как изложено в п.2.1.3. Сыворотки
пригодны для использования в течение 10 дней при температуре
хранения 4°С.
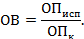
2.2.2.2. При постановке
реакции используют стандартные коммерческие диагностические наборы
согласно прилагаемому к ним наставлению по применению.Для проведения
исследования применяют:-
микропипетки одноканальные автоматические;-
микропипетки 8- или 12-канальные автоматические;-
фотометр одно- или многоканальный с автоматической регистрацией
результатов.
https://www.youtube.com/watch{q}v=ytabout
Рекомендуется использовать анализатор иммуноферментный
фотоэлектрический АИФ-Ц-01С;-
микротитровальные пластмассовые (полистироловые) планшеты с 96
лунками;-
автоматическое или полуавтоматическое оборудование для промывания
пластин;-
термостат, обеспечивающий температуру 37 /-0,5°С;-
стаканы химические;-
колбы мерные;-
колбы Эрленмейера;-
пробирки;-
пипетки градуированные вместимостью 1 и 10 см.



